
기술문서
개발자는 제품의 위험관리가 실제적으로 이루어지고 있음을 허가 당국에 증명하여야 하며 이때 증명하는 서류를 ‘기술문서’ 라 힙니다. 해당 제품의 안전성 및 성능 등 품질에 관한 자료로서 원재료, 구조, 사용목적, 사용방법, 작용원리, 사용 시 주의사항, 시험규격 등이 포함된 문서입니다. 또한 허가 당국은 개발자가 제시하는 기술문서가 안전성 및 성능을 만족하는지 규정에 따라 검토하게 되며 이 과정을 ‘기술문서 심사’라 합니다.
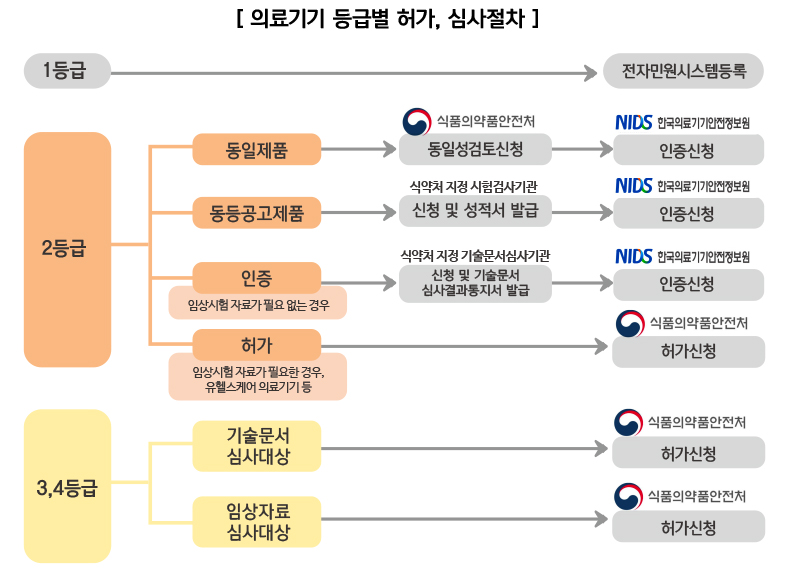
기술문서 심사대상
의료기기 기술문서 심사 대상은 ‘1등급(허가대상), 2등급∼4등급 의료 기기인 경우에 해당합니다. 다만 2등급 중 ’동일제품, 동등공고제품‘의 경우는 기술문서 심사대상에서 면제됩니다.
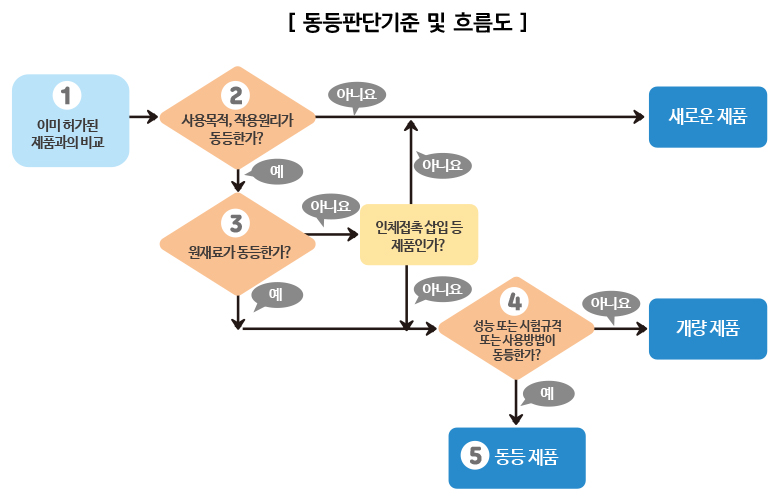
▣ 동등성 평가 : ‘기존에 판매되고 있는 다른 제품’이 이미 안전성과 효과성을 확보하고 있는 경우, 이와 기능, 성능, 효과, 안전을 확보하는 방법이 동일하다면, 기존의 제품이 확보 해 놓은 효과성과 안정성을 인정하는 제도
▣ 식약처 의료기기 전자민원창구 사이트 접속 http://emed.mfds.go.kr > 정보마당 > 업체/제품
정보 > 업소명, 품목명, 제품명 등으로 원하는 제품 검색해 조회 가능
기술문서 제출자료
1. 이미 허가·인증 받은 제품과 비교한 자료
2. 사용목적에 관한 자료 (해당되는 경우에 한함)
3. 작용원리에 관한 자료 (해당되는 경우에 한함)
4. 제품의 성능 및 안전을 확인하기 위한 다음의 자료 (해당되는 경우에 한함)
가. 전기·기계적 안전에 관한 자료
나. 생물학적 안전에 관한 자료
다. 방사선에 관한 안전성 자료
라. 전자파 안전에 관한 자료
마. 성능에 관한 자료
바. 물리화학적 특성에 관한 자료
사. 안정성에 관한 자료
5. 기원 또는 발견 및 개발경위에 관한 자료 (해당되는 경우에 한함)
6. 임상시험에 관한 자료 해당하는 경우 한함)
7. 외국의 사용현황 등에 관한 자료 (해당되는 경우에 한함)
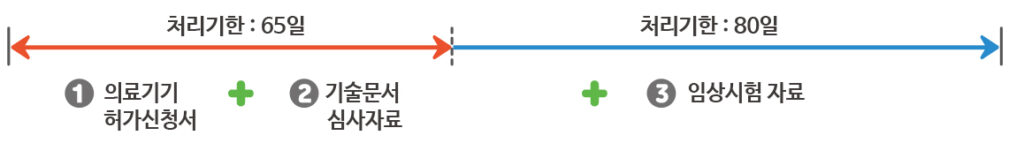
첨부자료의 범위에 따른 민원 처리 기한
1. 임상시험자료 불필요 : 허가신청서와 임상시험자료가 제외된 기술문서 심사자료에 대한 민원 처리기한은 65일이며,
기술 문서 심사자는 55일 내에 업무를 처리하여야 합니다. (허가 담당 업무 10일 제외)
2. 임상시험자료 필요 : 허가신청서와 임상시험자료가 포함된 심사자료에 대한 민원처리 기한은 80일이며,
기술문서 심사자는 70일 내에 업무를 처리하여야 합니다.(허가 담당 업무 10일 제외)
기술문서 빠른상담문의

